近日,我中心赵明、段金廒教授与中医学院·中西医结合学院陶伟伟教授研究团队在抗胰腺癌研究方面取得新进展,相关成果在线发表于Biomaterials (IF: 15.30; JCR分区: Q1)及ACS Applied Materials and Interfaces(IF: 10.38; JCR分区: Q1)。这是该团队继2021年研究报道(Pharmacological Research; IF: 10.334; JCR分区: Q1)后在本领域的最新研究进展。
胰腺癌是威胁人类健康的恶性肿瘤之一,生存率低,临床治疗手段选择有限,亟需探索新的诊疗策略。
CRISPR/Cas9基因编辑系统在生物、医学等领域表现出巨大应用潜力。传统的方法是利用病毒作为载体,然而病毒会带来突变、免疫反应及毒性等多种风险。为了克服这些障碍,研究团队构建了一种新型纳米载体平台,该平台由多分支金纳米章鱼核心和介孔聚多巴胺壳组成,这种多齿(支)状的金纳米结构在NIR-II窗口显示出明显的局域表面等离子体共振,具有优异的组织穿透能力和高光热转换效率。基于此载体平台,结合精准调控的基因编辑技术,装载了CRISPR-Cas9系统,在光和酸双重刺激下可实现CRISPR-Cas9的靶向输送和触发释放。该纳米复合物可通过下调肿瘤部位靶基因的表达,降低胰腺癌细胞的耐热性,从而促进细胞凋亡。该研究为未来的基因/光热癌症靶向治疗的临床转化提供了巨大潜力。相关研究成果以“Synthesis of multi-branched Au nanocomposites with distinct plasmon resonance in NIR-II window and controlled CRISPR-Cas9 delivery for synergistic gene-photothermal therapy”为题在线发表于生物材料领域权威杂志Biomaterials。陶伟伟教授为该论文第一作者,赵明教授、段金廒教授和马勇教授为共同通讯作者。
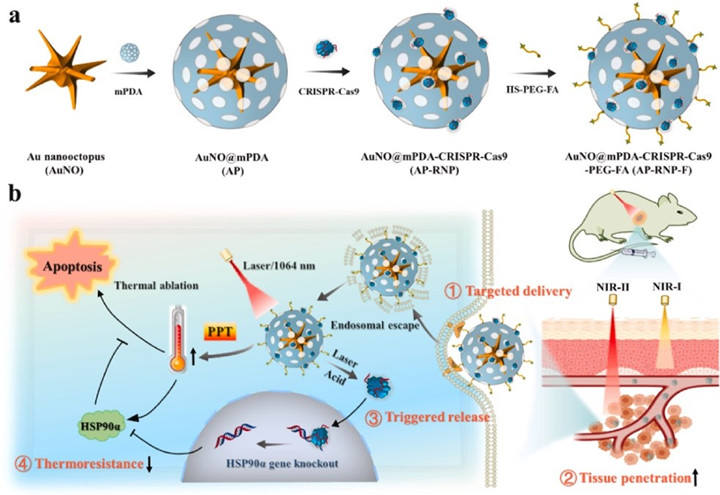
原文链接:https://www.sciencedirect.com/science/article/pii/S0142961222002617
中药鸦胆子降三萜类活性物质鸦胆子苦醇是一种独特的Nrf2通路抑制剂,为了克服光疗中肿瘤微环境处于氧化应激状态,触发抗氧化系统进而干扰药效,团队开发了一种集成光疗纳米平台,可共同递送中药鸦胆子降三萜类活性物质鸦胆子苦醇、光敏剂Ce6和MnO2,通过促进活性氧 (ROS) 的产生、降低肿瘤抵抗力和诱导铁死亡来提高抗胰腺癌效果。其中,释放的鸦胆子苦醇可以有效抑制Nrf2抗氧化防御途径,引起谷胱甘肽过氧化物酶4 (GPX4) 和铁蛋白重链 (FTH) 失活继而引起铁死亡,大大增强抗胰腺癌作用。该工作基于学科交叉研究,通过抑制应激防御系统和诱导铁死亡,克服光疗中因缺氧和高热而引发的肿瘤抵抗,实现了鸦胆子降三萜类活性物质抗胰腺癌提质增效的新突破。相关研究成果以“Enhanced ROS-Boosted Phototherapy against Pancreatic Cancer via Nrf2-Mediated Stress-Defense Pathway Suppression and Ferroptosis Induction”为题发表在美国化学学会旗下著名刊物ACS Applied Materials and Interfaces。陶伟伟教授为该论文第一作者,赵明教授、段金廒教授和孙东东教授为共同通讯作者。
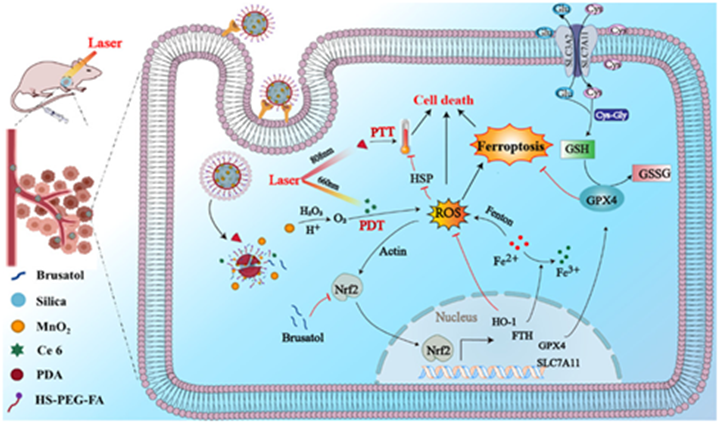
上述研究获得国家自然科学基金(81873096、81403041)、江苏省高校优势学科等项目资助。